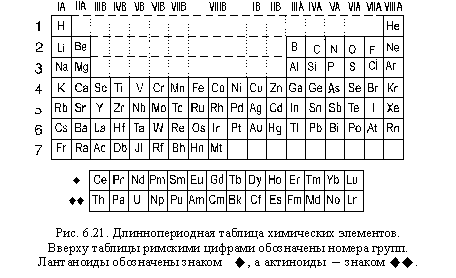
Современная химия представляет собой огромное поле исследований, которые помогают нам лучше понять состав веществ и их взаимодействия. Один из самых первых элементов, открытых человечеством, — это водород. Открытый в XIX веке, он был признан первым среди всех химических элементов. Интересно, что химический знак водорода — Н, был установлен сразу в двух группах периодической системы Д.И. Менделеева: ia и viia.
Принадлежность водорода к группам ia и viia не случайна. Эмпирически полученные данные указывают на то, что водород может образовывать соединения с другими элементами в разных пропорциях, что определяется тем, с кем водород реагирует и какая радикальная реакция происходит. Именно поэтому водород можно увидеть как на графике группы ia, так и на графике группы viia.
В целом, позиция водорода в таблице Менделеева говорит о его особом положении среди элементов периодической системы. Водород обладает свойствами как металлов (это видно по его электроотрицательности и валентности), так и неметаллов (это видно по водородным связям и его химическим реакциям). Это объясняет его двойную принадлежность к группам ia и viia.
Почему водород в ia и viia группах?
Расположение химического знака водорода в ia и viia группах таблицы периодических элементов может быть объяснено его уникальными свойствами и химическим поведением.
Водород является самым легким элементом в периодической системе и имеет одну электронную оболочку. В сочетании с его невысокой электроотрицательностью и малым атомным радиусом, водород может образовывать соединения как с металлами, так и с неметаллами.
В первой группе(ia) вместе с водородом находятся щелочные металлы — литий, натрий, калий и прочие. Они образуют ион с положительным зарядом, поэтому их свойства и реактивность схожи. Водород в этой группе образует ионы с отрицательным зарядом и вступает в реакции с этиленами.
В седьмой группе (viia) вместе с водородом находятся галогены — фтор, хлор, бром, йод и астат. Галогены имеют высокую электроотрицательность и образуют соединения с водородом, обладающими различными свойствами. Галогены, также как и водород, образуют ионы с отрицательным зарядом.
Таким образом, расположение водорода в ia и viia группах обусловлено его способностью образовывать ионы с различными зарядами и вступать в реакции с различными классами химических элементов.
Водород — уникальный элемент
Во-первых, водород является легчайшим элементом и самым распространенным во всей Вселенной. Он обладает наименьшей атомной массой и состоит из одного протона и одного электрона.
Во-вторых, водород может быть представлен в разных физических состояниях, включая газообразное, жидкое и твердое. При нормальных условиях он является газом без цвета и запаха.
В-третьих, водород является универсальным топливом. При сжигании он образует воду, а в процессе этого выделяется большое количество энергии. Поэтому водород активно используется в водородных топливных элементах, в ракетостроении и других отраслях промышленности.
В-четвертых, водород обладает свойством проявлять металлические и неметаллические свойства в зависимости от условий. Водород можно использовать в качестве катализатора при многих химических реакциях. Он также проявляет амфотерные свойства и может реагировать как с основаниями, так и с кислотами.
И, наконец, водород играет важную роль в биологических процессах. Он входит в состав молекул воды и многих органических соединений. Водород необходим для жизни всех организмов и является основным элементом в составе жиров, углеводов и белков.
Свойства и особенности водорода
Водород — единственный элемент, который может образовывать два близких последовательности химических элементов в таблице Менделеева: первую серию элементов (с увеличивающимися атомными номерами от 3 до 10) и седьмую серию элементов (с атомными номерами от 57 до 71).
Самым известным свойством водорода является его способность образовывать стабильные соединения с другими элементами, такими как кислород, углерод и азот. Это делает водород важным компонентом многих органических соединений, включая воду, кислородные функциональные группы и другие биохимические соединения.
Водород обладает высокой воспламеняемостью и может гореть в контакте с кислородом. Это свойство делает его полезным в ряде приложений, включая использование в качестве производства тепла и энергии.
Одной из особенностей водорода является его легкость и подвижность. Он является газом на комнатной температуре и обладает низкой плотностью, что делает его идеальным для использования в аэростатике и ракетостроении.
Водород также проявляет свойства катиона и аниона, в зависимости от условий и окружающей среды. Это делает его важным игроком в химических реакциях и реакциях окисления-восстановления.
Из-за своих уникальных свойств, водород используется во многих отраслях науки и промышленности. Он может быть использован в качестве сырья для производства аммиака, водородной пероксида, метана и других химических соединений. Также водород является перспективным источником энергии и используется в процессе генерации электроэнергии через топливные элементы.
Таким образом, водород является уникальным элементом с множеством интересных свойств и широким спектром применений в науке и промышленности. Его наличие в ia и viia группах периодической системы элементов объясняется его химическими особенностями и способностью образовывать соединения с различными элементами.
Электроотрицательность и химическое поведение
Химический знак водорода (H) находится в ia и viia группах периодической таблицы из-за его особого положения в периодической системе элементов. Водород имеет электроотрицательность 2,2 на шкале Полинга. Из-за сравнительно высокой электроотрицательности водороду свойственно образовывать связи как с металлами, так и с неметаллами, что обусловливает его присутствие и в первой и в седьмой группе.
В первой группе водород образует связи с щелочными металлами (например, литием и натрием), образуя гидриды. Эти связи характеризуются ионным типом связи, где водородные ионы H- эквивалентны аниону. В то же время, в седьмой группе водород образует связи с галогенами (например, фтором и хлором), образуя ковалентные связи. В этих связях водород участвует как положительный ион H+.
Таким образом, химический знак водорода находится и в ia и в viia группах периодической таблицы, благодаря его особым свойствам в образовании химических связей и его электроотрицательности.
Расположение водорода в ia и viia группах
Химический знак водорода (H) в таблице элементов периодической системы находится в ia и viia группах. Это может вызывать некоторые вопросы и недоумения у студентов и начинающих химиков.
Сначала давайте рассмотрим расположение водорода в группе ia. Группа ia, также известная как группа щелочных металлов, включает элементы, такие как литий (Li), натрий (Na) и калий (K). Они все являются мягкими, реактивными металлами. Они имеют одну валентную электронную оболочку, что делает их химически подобными.
Водород (H), с другой стороны, относится к неметаллам. Он имеет одну электронную оболочку с одним электроном. Однако он не располагается в группе ia, поскольку его свойства не совпадают с щелочными металлами. Вместо этого, водород по своим химическим свойствам более похож на галогены из группы viia.
Группа viia, или группа галогенов, включает элементы, такие как фтор (F), хлор (Cl), бром (Br) и йод (I). Галогены обладают высокой реактивностью и имеют семь электронов во внешней оболочке. Они тенденцию к образованию отрицательных ионов, так как им не хватает одного электрона для достижения стабильной электронной конфигурации.
Водород (H) имеет одну электронную оболочку с одним электроном, поэтому он может образовывать положительные ионы (H+) путем потери этого электрона. Это делает его похожим на галогены, которые также могут образовывать отрицательные ионы. Это объясняет его расположение в группе viia, рядом с галогенами.
В целом, химическое расположение водорода в ia и viia группах связано с его свойствами и электронной конфигурацией. Водаород не является ни металлом, ни галогеном, но его свойства и химическая реактивность более похожи на галогены, чем на щелочные металлы. Это позволяет ему находиться рядом с галогенами в таблице элементов.
| Группа | Элементы |
|---|---|
| ia | Li, Na, K |
| viia | F, Cl, Br, I, H |
Сходство с щелочными металлами
Аналогично щелочным металлам, водород может отдать один электрон, образуя положительный ион H+. Это свойство водорода объясняет его нахождение в первой группе периодической системы. Однако, в отличие от щелочных металлов, водород также может получать один электрон, образуя отрицательный ион H-. Поэтому водород может быть связан с элементами viia группы.
Сходство водорода с щелочными металлами не ограничивается только возможностью образования ионов. Он также имеет низкую плотность и низкую температуру плавления, что делает его схожим с щелочными металлами. Кроме того, водород часто используется в реакциях с веществами, свойственными щелочным металлам, например, с водой.
Таким образом, сходство водорода с щелочными металлами представляет собой интересный аспект его химических свойств и позволяет детальнее изучить его место в периодической системе элементов.
Сходство с галогенами
Однако, в отличие от галогенов, водород также может образовывать ионы H+ (протоны), проявляя тем самым металлические свойства. Это объясняет его внесение в таблицу Менделеева и размещение в группе I A и VII A, где находятся щелочные металлы и галогены соответственно.
Сходство водорода с галогенами также проявляется в химических свойствах. Вода, например, является бинарным соединением водорода с кислородом, а подобные соединения образуются и с другими элементами галогенной группы – фторидами (соединения с фтором), хлоридами (соединения с хлором), бромидами (соединения с бромом) и йодидами (соединения с йодом).
- Фториды – водород с фтором (HF).
- Хлориды – водород с хлором (HCl).
- Бромиды – водород с бромом (HBr).
- Йодиды – водород с йодом (HI).
Таким образом, сходство водорода с галогенами как по химическим свойствам, так и по размещению в таблице Менделеева, связано с его способностью образовывать ионы и соединения с другими элементами.
Вопрос-ответ:
Зачем водород расположен одновременно в ia и viia группах?
У расположения водорода в ia и viia группах есть свои причины. Во-первых, водород обладает особой электронной структурой, которая иногда позволяет ему подписываться на электроотрицательные элементы из viia группы и формировать с ними ковалентные соединения. Во-вторых, водород также способен образовывать ионные соединения с элементами ia группы, что объясняет его присутствие в данной группе.
Почему водород не принадлежит целиком к ia группе?
Водород не принадлежит полностью к ia группе, так как он имеет способность образовывать соединения и с элементами viia группы. Это связано с его особой электронной структурой и возможностью формировать ковалентные связи с электроотрицательными элементами, такими как халогены.
Какие факторы влияют на расположение водорода в ia и viia группах?
Расположение водорода в ia и viia группах обусловлено несколькими факторами. Один из них — его способность образовывать ковалентные связи с электроотрицательными элементами из viia группы. Другой фактор — способность водорода образовывать ионные соединения с элементами ia группы. Эти два фактора в совокупности определяют расположение водорода в этих двух группах.
Какие элементы соединяются с водородом и почему?
Водород способен соединяться с элементами из viia группы, такими как фтор, хлор, бром и йод, и образовывать с ними ковалентные соединения. Это связано с особой электронной структурой водорода, которая позволяет ему заключать ковалентные связи с электроотрицательными элементами. Также водород может образовывать ионные соединения с элементами из ia группы, такими как литий, натрий и калий.
Какова химическая природа связи между водородом и элементами viia группы?
Связь между водородом и элементами viia группы, такими как фтор, хлор, бром и йод, является ковалентной. В этой связи электроотрицательность водорода увеличивается, что позволяет ему приобретать один или несколько электронов от электроотрицательного элемента из данной группы и формировать ковалентное соединение.
Почему химический знак водорода находится в ia группе?
Химический знак водорода (H) находится в ia группе, потому что он обладает свойствами химического элемента из этой группы. В группе ia расположены щелочные металлы, которые характеризуются одной валентностью и образованием положительных ионов, а водород образует положительные ионы, имеет одну валентность и сходные свойства с другими элементами группы.
Почему химический знак водорода находится в viia группе?
Химический знак водорода (H) находится в viia группе (также называемой группой галогенов), потому что в ряду галогенов он обладает сходными свойствами с элементами этой группы. Галогены — это химические элементы, имеющие выраженную электроотрицательность, образующие отрицательные ионы с одной валентностью. Водород образует отрицательные ионы и электроотрицателен, поэтому его химический знак находится в viia группе.